§ 1.1. Строение вещества
Строение вещества. Известно, что все тела состоят из отдельных очень малых частиц — атомов и молекул. Каждый химический элемент — водород, углерод, медь, алюминий и прочие — состоит из атомов определенного вида. Молекулы образуются из нескольких атомов одного или различных химических элементов.
Рис. 1.1.1. Электронные оболочки
 Строение
атома весьма сложно. Упрощенно атом можно
представить в виде ядра, окруженного оболочкой.
Ядро состоит из тяжелых, равных по массе, протонов и нейтронов,
а оболочка образована из легких, постоянно
движущихся с чрезвычайно большой скоростью,
мельчайших частиц — электронов.
Электроны настолько подвижны, что в течение
каждой секунды успевают пробежать вокруг ядра
атома до 10 000 000 000 000 000 раз (1016).
Масса электрона в 1840 раз меньше массы протона и
нейтрона. В атомах разных химических элементов
содержится различное количество протонов,
нейтронов и электронов.
Строение
атома весьма сложно. Упрощенно атом можно
представить в виде ядра, окруженного оболочкой.
Ядро состоит из тяжелых, равных по массе, протонов и нейтронов,
а оболочка образована из легких, постоянно
движущихся с чрезвычайно большой скоростью,
мельчайших частиц — электронов.
Электроны настолько подвижны, что в течение
каждой секунды успевают пробежать вокруг ядра
атома до 10 000 000 000 000 000 раз (1016).
Масса электрона в 1840 раз меньше массы протона и
нейтрона. В атомах разных химических элементов
содержится различное количество протонов,
нейтронов и электронов.
Рис. 1.1.2. Схематическое изображение атома меди
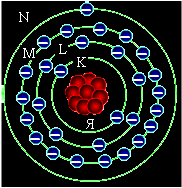 Электроны
располагаются вокруг ядра Я (рис. 1)
несколькими слоями (оболочками) на очень большом
по сравнению со своими размерами расстоянии.
Оболочки обозначаются латинскими буквами K,
L, M, N, O, P,и Q (в порядке удаления
их от ядра). Самым простым атомом является атом
водорода: он имеет только один электрон,
расположенный на оболочке К. Атом гелия (рис.
2, а) имеет два электрона, расположенных на
оболочке К, атом кислорода (рис. 2, б) — восемь
электронов, расположенных на оболочках К и L. В атоме меди электроны
располагаются на четырех оболочках. В наиболее
сложных атомах радия и урана электроны
располагаются на всех семи возможных оболочках.
В пределах каждой оболочки электроны могут
двигаться вокруг ядра только по строго
определенным или, как их принято называть,
разрешенным орбитам (см. рис. 2). Согласно
современным представлениям каждый из имеющихся
в атоме электронов стремится занять одну из
ближайших к ядру разрешенных орбит, остальные
возможные орбиты пустуют. Электрон, вращающийся
на самой близкой к ядру орбите, обладает
минимальным количеством энергии, а вращающийся
на самой удаленной максимальной энергией.
Переход электрона с одной орбиты на другую
связан с изменением его энергетического уровня.
Электроны
располагаются вокруг ядра Я (рис. 1)
несколькими слоями (оболочками) на очень большом
по сравнению со своими размерами расстоянии.
Оболочки обозначаются латинскими буквами K,
L, M, N, O, P,и Q (в порядке удаления
их от ядра). Самым простым атомом является атом
водорода: он имеет только один электрон,
расположенный на оболочке К. Атом гелия (рис.
2, а) имеет два электрона, расположенных на
оболочке К, атом кислорода (рис. 2, б) — восемь
электронов, расположенных на оболочках К и L. В атоме меди электроны
располагаются на четырех оболочках. В наиболее
сложных атомах радия и урана электроны
располагаются на всех семи возможных оболочках.
В пределах каждой оболочки электроны могут
двигаться вокруг ядра только по строго
определенным или, как их принято называть,
разрешенным орбитам (см. рис. 2). Согласно
современным представлениям каждый из имеющихся
в атоме электронов стремится занять одну из
ближайших к ядру разрешенных орбит, остальные
возможные орбиты пустуют. Электрон, вращающийся
на самой близкой к ядру орбите, обладает
минимальным количеством энергии, а вращающийся
на самой удаленной максимальной энергией.
Переход электрона с одной орбиты на другую
связан с изменением его энергетического уровня.
Электроны, расположенные на внешней, самой удаленной от ядра оболочке называются валентными. Они определяют способность атомов данного элемента вступать в химические связи друг с другом и с атомами других элементов, а также электропроводность различных материалов.
Рис. 1.1.3. Электрон
 Электрон
никто никогда не видел. Радиус его в 400 000 000 000 раз
(4·1011) меньше одного миллиметра. Самый
совершенный из известных нам микроскопов не
позволяет видеть такие частицы. Масса электрона
в 1 000 000 000 000 000 000 000 000 000 раз (11·1027) меньше, чем
масса однограммовой гирьки. Очевидно, что такую
частицу нельзя взвесить на весах.
Электрон
никто никогда не видел. Радиус его в 400 000 000 000 раз
(4·1011) меньше одного миллиметра. Самый
совершенный из известных нам микроскопов не
позволяет видеть такие частицы. Масса электрона
в 1 000 000 000 000 000 000 000 000 000 раз (11·1027) меньше, чем
масса однограммовой гирьки. Очевидно, что такую
частицу нельзя взвесить на весах.
Рис. 1.1.4. Электрические заряды
 Ядро и электроны обладают электрическими зарядами.
Протоны имеют положительный заряд, электроны —
отрицательный заряд, равный 1,6·10-19
кулона. Заряды протона и
электрона равны. Нейтроны не имеют
электрического заряда, т. е. являются
нейтральными частицами. Между отрицательно
заряженными электронами и положительно
заряженным ядром возникают электрические силы,
которые удерживают электроны в атоме и
заставляют их двигаться вокруг ядра. Эти
электрические силы определяют и размеры атомов. При очень тесном сближении двух
атомов возникают огромные силы отталкивания
между их электронами. Они препятствуют
дальнейшему сближению и определяют объем,
занимаемый атомом; внутрь этого объема не может
проникнуть другой атом.
Ядро и электроны обладают электрическими зарядами.
Протоны имеют положительный заряд, электроны —
отрицательный заряд, равный 1,6·10-19
кулона. Заряды протона и
электрона равны. Нейтроны не имеют
электрического заряда, т. е. являются
нейтральными частицами. Между отрицательно
заряженными электронами и положительно
заряженным ядром возникают электрические силы,
которые удерживают электроны в атоме и
заставляют их двигаться вокруг ядра. Эти
электрические силы определяют и размеры атомов. При очень тесном сближении двух
атомов возникают огромные силы отталкивания
между их электронами. Они препятствуют
дальнейшему сближению и определяют объем,
занимаемый атомом; внутрь этого объема не может
проникнуть другой атом.
Электрические заряды не создаются и не исчезают; они могут перемещаться от одного тела к другому или смещаться внутри тела или молекул атомов (закон сохранения электрических зарядов).
Рис. 1.1.5. Ядро атома
 Ядра атомов являются значительно
более устойчивыми системами, чем их электронные
оболочки. Объясняется это тем, что между
протонами и нейтронами действуют огромные силы
взаимного притяжения, называемые ядерными
силами. Эти силы значительно больше сил
взаимного отталкивания между одноименными
электрическими зарядами протонов, поэтому ядра
атомов большинства химических элементов
разделить на части очень трудно.
Ядра атомов являются значительно
более устойчивыми системами, чем их электронные
оболочки. Объясняется это тем, что между
протонами и нейтронами действуют огромные силы
взаимного притяжения, называемые ядерными
силами. Эти силы значительно больше сил
взаимного отталкивания между одноименными
электрическими зарядами протонов, поэтому ядра
атомов большинства химических элементов
разделить на части очень трудно.
Несмотря на то, что все атомы состоят из электрически заряженных частиц, мы не наблюдаем электрических сил притяжения и отталкивания между окружающими нас телами. Это происходит потому, что общий отрицательный заряд всех электронов в атоме равен положительному заряду ядра, а атом в целом электрически нейтрален. Поэтому и тело, состоящее из атомов, не обладает электрическим зарядом и не проявляет электрических свойств.
Атомы различных элементов отличаются друг от друга не только числом электронов, но и строением ядер. Чем больше электронов в оболочке атома, тем больше должно быть протонов в его ядре. Заряд ядра зависит от числа положительных частиц — протонов. Масса ядра атома зависит от числа протонов и нейтронов.
Физическая природа электричества. Под электричеством в широком смысле понимают всю совокупность электромагнитных явлений, которые представляют собой проявления электромагнитного поля и его взаимодействие с веществом. В узком смысле слово "электричество" употребляется для количественного определения электрического заряда.
Многие электрические явления и электрические свойства тел можно весьма просто и наглядно объяснить на основе электронной теории. Согласно этой теории атомы при определенных условиях могут терять электроны или приобретать их от соседних атомов. В этом случае они перестают быть нейтральными, так как равновесие их электрических зарядов нарушается. Атомы, потерявшие часть своих электронов, становятся положительно заряженными и называются положительными ионами. Атомы, получившие избыточные электроны, становятся отрицательно заряженными и называются отрицательными ионами.
Процесс превращения нейтральных атомов в электрически заряженные частицы — ионы, называют ионизацией. Ионизация может возникнуть только при сообщении атому определенного количества энергии: в виде тепла, путем бомбардировки его какими-либо частицами, при воздействии внешнего электрического поля и т. д. Наибольшая энергия требуется для освобождения валентных электронов. При сообщении атому сравнительно небольшой энергии валентные электроны кратковременно переходят на более удаленную орбиту, а затем перескакивают на прежнюю,
более близкую к ядру. Однако при достаточно большой энергии (энергии ионизации) эти электроны могут совершенно оторваться от ядра и стать свободными.Если в каком-либо теле накопятся электроны или ионы, то говорят, что в теле накопилось электричество. Такое тело становится электрически заряженным и приобретает электрические свойства. Эти свойства есть по сути дела проявление электрических сил, действующих между электронами и ядрами атомов. Тело, приобретая электроны, тем самым получает отрицательный заряд. При потере электронов тело приобретает положительный заряд.